Wir beraten und unterstützen mit unserer Expertise bei der Planung und Umsetzung von vielfältigen molekularbiologischen Techniken über DNA & RNA-Arbeiten, Klonierungsstrategien, Analyse von Protein-Protein Interaktionen bis hin zu Protein-Expression in E. coli, Hefen und Pflanzen-Systemen.
Melden Sie sich gerne bei uns, wenn Sie für neue Projekte Unterstützungsbedarf haben, Geräte Mitnutzen möchten oder Beratung bei molekularbiologischen Fragen benötigen.
Kooperationspartner:
- Abteilung Biobasierte Materialien
- Abteilung Biophysik
- Abteilung Intelligente Biointegrative Systeme
- Abteilung Pflanzen-Biotechnologie
- Forschungseinheit Molekulare und Synthetische Pflanzenvirologie
- Institut für Zellbiologie und Immunologie, Biomedical Engineering
- Institut für Grenzflächenverfahrenstechnik und Plasmatechnologie, Chemisch-physikalische Grenzflächen
Übersicht der Fachexpertise in der Funktionseinheit Molekularbiologie:

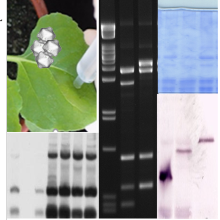
Beispiele (von links nach rechts): Plasmid-Karte einer Rekombinations-basierten Klonierung (Gateway), Ethidiumbromid-gefärbte DNA-Restriktionsfragmente aufgetrennt im Agarosegel, Nachweis von Virus-DNA Topoisomeren durch Southern Blot Analyse nach vorheriger Auftrennung im Chloroquin-haltigem Agarosegel, Analyse von posttranskriptionellem Genesilencing: RNA-Fraktion kleiner 200 nt aufgetrennt in einem Polyacrylamid-Gel mit SybrGold-gefärbt und dazugehörige small interfering (si)RNA Northern Blot Analyse
- Verschiedene Klonierungs- & Mutagenese-Methoden (z.B. PCR Techniken, Restriktionsenzym- & Rekombinations-basierte Klonierung, Gibson Assembly)
- E. coli Arbeiten (Transformation, Plasmid-DNA Isolation & Analyse)
- DNA & RNA Isolation aus Pflanzen, Bakterien und Hefen, Größenfraktionierung von Nukleinsäuren
- Gelelektrophorese (2D-Gelelektrophorese, Form und Größen-spezifische Trenntechniken, denaturierende Gele)
- Southern & Northern Blot Analysen (u.a. Plaque Lifts, siRNA Northern Blot)

Beispiele (von links nach rechts): Transiente Expression von Proteinen in Blättern durch die Technik der Agrobakterien-Infiltration, Auftrennung von Proteinen in einem SDS-Polyacrylamid-Gel mit Coomassie blau gefärbt und dazugehörige Western Blot Analyse, Nachweis einer Testprotein-Interaktion in Hefen durch Zwei-Hybrid System und in lebenden Pflanzenzellen durch Fluoreszenzresonanz-Energietransfer (FRET)
- Expression & Aufreinigung (Bakterien, Hefen, Pflanzen)
- In vivo Markierung
- In vitro & in vivo Interaktionsassay (Pull-down Assay, Hefe Zwei-Hybrid System, Fluoreszenz-basiert: bimolekulare Fluoreszenz Komplementation (BiFC) & Fluoreszenzresonanz-Energietransfer (FRET)
- Enzymatische Assay (Kinase, Methylase)
- Gelelektrophorese (SDS PAGE, Blue Native) & Western Blot Analyse
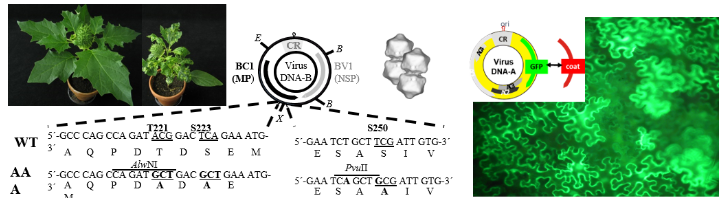
Beispiele (von links nach rechts): Gesunde und Geminivirus-infizierte Pflanze mit Symptomen, Genomkarte (zirkuläre DNA-B) von Geminiviren und Mutagenese-Strategie im BC1-Gen, Geminiviruspartikel, Genomkarte Geminivirus-Vektor zur Proteinexpression in Pflanzen hier für grün-fluoreszierendes Protein (GFP) und dazugehörige Fluoreszenzmikroskopie von GFP-exprimierenden Pflanzenzellen
- Transiente Protein Expression in verschiedenen Systemen (Pflanzen, Gewebekultur, Protoplasten) durch unterschiedliche Techniken (DNA-Transfektion, Agrobakterien-vermittelt; Partikelbeschuss)
- Agrobacterium tumefaciens Arbeiten (Transformation, Plasmid-DNA Isolation & Analyse)
- Etablierung transgener Pflanzen (Gewebekultur, Genotypisierung, Kreuzen)
- Infektionsmethoden (physikalische und biologische Techniken), Symptom-Bonitur und Analyse Virus-infizierter Pflanzen
- Diagnostik von ssDNA Viren & Satelliten (Phi29-basierte rolling circle Amplifikation (RCA)- Restriktionsfragment-Längenpolymorphismus (RFLP) Analyse, PCR, Southern Blot Analyse)
- Phytovirales Engineering (Virus-basierte Vektorsysteme für Expression und Gensilencing)
- Fluoreszenzmikroskopie (Lebendbeobachtung), Inhibitor-Studien
Die Geräteausstattung der Funktionseinheit kann in Absprache mit genutzt werden. Zum Beispiel:
- EdgeX7 Imaging System (Vilber Lourmat)
- Infinite M200 Pro (Tecan)
- Elektroporationsanlage Genepulser II (Biorad)
- Biolistic PDS-1000/He Particle Delivery System (Biorad)
- FastPrep-24 (MP)
- Ausstattung für die Gelelektrophorese
- Inkubatoren
- PCR-Geräte
Team
Rebecca Hummel
Technische Assistentin

Tatjana Kleinow
PD Dr.Privatdozentin
[Foto: T. Kleinow]